Wyniki dla: badania
Ksenoprzeszczep, nazywany inaczej ksenograftem jest to transplantacja tkanki przedstawiciela jednego gatunku do tkanek osobnika innego gatunku, np. przeniesienie tkanki bydlęcej do organizmu człowieka. Przeszczepy międzygatunkowe znalazły zastosowanie w wielu gałęziach medycyny, stosowane są głównie w medycynie naprawczej.
Przeszczepy w stomatologii
Ksenoprzeszczepy stanowią potencjalna formę leczenia schyłkowej niewydolności organów, zwłaszcza w krajach wysokorozwiniętych, gdzie występuje wiele chorób cywilizacyjnych w stopniu zaawansowanym, chociaż ich stosowanie wzbudza wiele kontrowersji medycznych, prawnych czy etycznych. Wartą uwagi kwestią jest starzenie się większości tkanek zwierzęcych w innym czasie, niż tkanek ludzkich, a także możliwość przeniesienia chorób odzwierzęcych poprzez ksenoprzeszczep na człowieka. Początkowo za potencjalnego dawcę tkanek do przeszczepu dla człowieka obrano szympansa – sugerowano się dużym pokrewieństwem oraz podobnymi rozmiarami narządów, jednak zrezygnowano z tego gatunku, gdyż jest on poważnie zagrożony wyginięciem. Następnie jako gatunek naczelnych dalej spokrewniony zaczęto eksperymentować z pawianami – ksenoprzeszczepy od zwierząt naczelnych zostały jednak wyparte przez dawców innych gatunków, takich jak świnie i bydło, ze względu na zmniejszone ryzyko transmisji chorób odzwierzęcych. Obecnie głównym dawcą do przeszczepów międzygatunkowych jest świnia, stosuje się także komórki bydlęce. Choroby takie nazywane są ksenozoonazami (gr. xenos –obcy, zoon-zwierzę), jeśli chodzi o choroby odzwierzęce to schorzeniami, którego lekarze i pacjenci obawiają się najbardziej jest encefalopatia gąbczasta bydła (BSE), potocznie nazywana chorobą wściekłych krów oraz endogenne schorzenia retrowirusowe u świń. Większość przeszczepów ksenogenicznych służy odbudowie ubytków kostnych oraz innych tkanek łącznych. W stomatologii przeszczepy międzygatunkowe stosowane są głównie w implantologii oraz periodontologii, do regeneracji recesji dziąseł. Obszar szczękowo-twarzowy posiada wiele właściwości, dzięki którym jest przedmiotem zainteresowania inżynierii tkankowej, należą do nich łatwość wglądu, a więc i kontroli tkanek przed i po przeszczepie, dobry dostęp, zwłaszcza jeśli chodzi o samą jamę ustną, a także wymierne efekty leczenia, nawet małych defektów w porównaniu do innych części ciała. Technika sterowanej regeneracji tkanek (GTR ang. guided tissue regeneration) dla tkanek przyzębia oraz sterowanej regeneracji kości (GBR ang. guided bone regeneration) do terapii zmian wyrostków zębodołowych są stosowane w stomatologii od lat 80′ ubiegłego stulecia, natomiast przeszczepy kości wołowych miały miejsce już w pierwszej połowie XX wieku w leczeniu wad międzykostnych.
Odbiałczony ksenoprzeszczep kości wołowej, w skrócie DBB (Deproteinized Bovine Bone) posiada podobny do ludzkiej kości skład chemiczny oraz ułożenie przestrzenne i ze względu na te właściowości jest używany do wspomagania rozwoju nowej tkanki kostnej w bezpośrednim kontakcie z przeszczepem. Transplanty DBB są szeroko stosowane w różnych zabiegach stomatologicznych, jednakże ich dodatkowo pozytywny wpływ z użycia wraz z implantami zębów lub razem z GTR w leczeniu ubytków spowodowanych chorobami przyzębia nie jest jednoznacznie potwierdzony naukowo i do tek pory pozostaje kwestią sporną. Sugeruje się, aby DBB był stosowany raczej jako kościozgodny materiał wypełniający dla zapewnienia utrzymania przestrzeni niż jako substancja pobudzająca rozwój kości. Wynik terapii DBB jest według źródeł naukowych wysoce zależny od układu i rozmiaru leczonej wady.Ksenoprzeszczep DBB daje zmniejszoną odpowiedź immnologiczną w stosunku do przeszczepów, które nie są pozbawione białka, ponieważ nie zawiera substancji organicznych, które są najczęściej niezgodne tkankowo, ze względu na to, przeszczepy DBB są rzadziej odrzucane przez pacjentów. Obróbka kości wołowej prowadzona jest w sposób, który gwarantuje także usunięcie obecnych ewentualnie prionów, które potencjalnie mogłyby wywołać chorobę Cretzfelda-Jacoba.
Grupa naukowców z Berkeley Lab opracowała materiał, który jest uważany za najtwardszy i najbardziej wytrzymały na świecie. Materiał ten nazywany jest szkłem metalowym (z ang. metallic glass) i wykonany jest ze stopu palladu i szkła. W skład materiału wchodzi 79% palladu, 3,5% srebra, 6% fosforu, 9,5 % krzemu oraz 2% germanu.
Implanty przyszłości – najlepszy materiał na implanty
Materiały szklane są wprawdzie z natury mocne, co wynika z braku mikrostruktury krystalicznej, jednak ich wadą jest duża kruchość, która często objawia się skrajnym brakiem odporności na zarysowania i pękaniem. W przeciwieństwie do zwykłych szkieł szkła metalowe posiadają zdolność do przesuwania powstających rys w postaci pasm i blokowaniu ich rozprzestrzeniania, a tym samym łączą w sobie zalety kruchych materiałów ceramicznych i skrajnie twardych metali. Wytworzony materiał amorficzny wykazuje wyjątkową odporność na zniszczenie, wykraczającą poza dotychczas osiągnięte parametry dla najtwardszych i najmocniejszych tworzyw. Szkło metalowe ze stopem palladu zostało poddane próbom na rozciąganie, gdzie wykazało zadowalające wyniki – dzięki temu wiadomo, że będzie ono mogło zostać zastosowane tam, gdzie oprócz twardości konieczna jest także odporność na działanie sił sprężystości. W momencie powstania rysy na materiale z metalowego szkła wytwarza się wiązka rys, które otaczają pęknięcie i zapobiegają jego rozprzestrzenianiu się. Szkło metalowe ze stopem palladu jest dzięki temu wysoce odporne na działanie czynników uszkadzających. Ze względu na udział stopu palladu w przedstawionym szkle metalowym jego zastosowanie na szeroką skalę jest jak na razie ograniczone. Medycyna wiąże wiele nadziei ze szkłami metalowymi; obecnie trwają badania nad zastosowaniem takich materiałów w implantologii, głównie jeśli chodzi o wspomaganie leczenia złamań kości, chociażby w postaci śrub łączących ich fragmenty. Jest bardzo prawdopodobne, według wypowiedzi Marios D. Demetriou – jednego z twórców materiału, że będzie on stosowany w produkcji implantów zębowych oraz innych implantów stosowanych w medycynie, ponieważ koszty ich produkcji są bardzo wysokie, dzięki czemu zastosowanie tak drogiego materiału mogłoby zostać uzasadnione. Nowe twardsze i wytrzymalsze na działanie sił wszczepy mogłyby podnieść jakość życia pacjentów, u których zostałyby zastosowane, jednak, aby ocenić przydatność materiału konieczne jest uprzednie zbadanie jego wpływu na organizm oraz biozgodności z tkankami. Idealnie byłoby, gdyby opisywany biomateriał ulegał osseointegracji, podobnie jak związki tytanu, którymi pokrywa się obecnie stosowane implanty zębowe.
Wkłady koronowo-korzeniowe to małe uzupełnienia protetyczne, które umieszczane są na stałe w jamie ustnej pacjenta w celu wzmocnienia struktury korzenia oraz odbudowania struktur korony zęba. Wkłady koronowo-korzeniowe umożliwiają także wykorzystanie zębów poddanych leczeniu endodontycznego jako filarów, na których opierają się konstrukcje protetyczne. Nie każdy ząb leczony kanałowo nadaje się do wykonania wkładu koronowo-korzeniowego; zęby rozchwiane, złamane lub z występującymi zmianami okołowierzchołkowymi uniemożliwiają wykonanie uzupełnień tego rodzaju.
Materiałami stosowanymi do wykonania wkładów są ze stopy metali takie jak stopy chromoniklowe, stopy złota i tytanu oraz tlenek cyrkonu, który zapewnia bardziej estetyczny kolor (biały lub kremowy) oraz jest biokompatybilny, włókno szklane i materiały złożone – kompozyty, które zapewniają niezmienność barwy oraz są bardziej sprężyste niż inne materiały. istnieją także wkłady koronowo-korzeniowe wykonane z włókna węglowego, jednak nie są one powszechnie stosowane ze względu na ciemny kolor, natomiast posiadają bardzo dużą wytrzymałość oraz sprężystość.
Rodzaje wkładów koronowo-korzeniowych
W leczeniu protetycznym stosowane są wkłady standardowe i indywidualne. Wkłady standardowe są produkowane fabrycznie w określonych rozmiarach i kształtach, mogą być gwintowane (do wkręcania) lub gładkie, natomiast wkłady indywidualne wykonywane są dla konkretnego pacjenta. Najnowocześniejsze wkłady z włókna szklanego, stosowane we współczesnej stomatologii, gwarantują stabilność oraz trwałość odbudowy zęba np. po leczeniu endodontycznym, lub w przypadku złamania korony.
Zalety wkładów standardowych:
• możliwość zastosowania w trakcie jednej wizyty
• szybsze odbudowanie filaru protetycznego
Wady:
• mniejsza wytrzymałość mechaniczna
• ograniczony wybór kształtów i rozmiarów
Wskazania:
• natychmiastowe odbudowanie korony złamanego zęba
• konstrukcje tymczasowe wymagające obecności wkładu
• odbudowa zębów o niepewnym wyniku leczenia, co do których zachodzi możliwość usunięcia w niedalekiej przyszłości – mniejsze ryzyko straty finansowej
Wkłady indywidualne są modelowane zgodnie z kształtem korzenia i pozostałości korony pacjenta. Pozwala to na lepsze dopasowanie rodzaju wkładu do planowanego uzupełnienia protetycznego, które będzie na nim oparte.
Zalety wkładów indywidualnych:
• możliwość uzyskania kształtu dopasowanego do konstrukcji
• zwiększenie wytrzymałości mechanicznej
• większa trwałość
Wady:
• większe koszty
We wkładach indywidualnych wyróżnia się część korzeniową i koronową, które współdziałają ze sobą, co prowadzi do wzmocnienia struktur zęba, co jest konieczne dla właściwego przenoszenia sił żucia poprzez ozębną na kość.
Badania przed zabiegiem
Przed wykonaniem wkładu konieczne jest wykonanie przeglądu stomatologicznego, wykluczenie chorób przyzębia oraz próchnicy. Aby dokładnie ocenić stan jamy ustnej pacjenta wskazane jest wykonanie zdjęcia rentgenowskiego, które pozwala na poznanie stanu okolicy okołowierzchołkowej, kości oraz samego korzenia. Badania pozwalają ocenić ryzyko niepowodzenia oparcia konstrukcji na filarze w postaci wkładu. Wykonywanie prześwietleń rentgenowskich jest przeciwwskazane u kobiet w ciąży. Więcej
Magazyn Stomatologiczny, 2011, XXI, 1, 76-82:
Autor: Marcin Krufczyk – Lekarz stomatolog, Zabrze | Kontakt e-mail: marcin@dentysta.eu
Badanie ankietowe, w którym wzięło udział ponad 3500 respondentów z całej Polski oraz z innych krajów, miało na celu w celu wyjaśnienie głównych przyczyn dentofobii i przybliżenie metod radzenia sobie ze stresem w gabinecie stomatologicznym i poczekalni. Poruszono w nim także takie kwestie, jak to, które znieczulenia są odbierane przez pacjentów jako najbardziej bolesne i jaką postawę powinien przyjąć lekarz, aby wyzbyć się negatywnego napięcia we wzajemnej relacji z pacjentem.
Dentofobia
Od zarania dziejów dentysta był postrzegany jako postać negatywna, kojarząca się głównie z bólem i nieprzyjemnymi doznaniami. Ten utarty pogląd sprawia, że ludzie boją się wizyt u dentysty, a niektórzy unikają ich jak ognia. Skrajny strach powodujący ataki paniki i paraliżującą niechęć jest nazywany dentofobią (1, 2). Niechęć pacjenta na fotelu dentystycznym jest przeszkodą zarówno dla niego samego, jak i dla dentysty, a spowodowane strachem jego nadmierne pobudzenie i wrażliwość na choćby najlżejsze dotknięcie lekarza uniemożliwia wręcz leczenie. Czy jest na to sposób? Dentyści prześcigają się w stosowaniu przeróżnych metod zmniejszania napięcia w kontakcie z pacjentami. Która z tych metod jest skuteczna i czy w ogóle można się wyzbyć strachu i poczucia lęku?
Cel pracy
Celem badania było uchwycenie podstawowych czynników wywołujących stres podczas wizyty u stomatologa, a także znalezienie złotego środka, który pozwoli na zmniejszenie napięcia w relacji dentysta – pacjent. Ponadto podjęto próbę:
• ustalenia natężenia strachu i jego wpływu na częstość wizyt u dentysty,
• wychwycenia najbardziej stresogennych zabiegów,
• przedstawienia wzorcowej postawy lekarza,
• określenia standardów wyposażenia gabinetu i poczekalni, które pozwolą na ograniczenie stresu pacjentów do minimum.
Materiały i metody
Badanie zostało przeprowadzone w formie anonimowej ankiety internetowej oraz jej drukowanego odpowiednika w celu potwierdzenia osiągniętych wyników. Ankieta była dostępna pod adresem internetowym dentofobia.1k.pl od 5 lipca do 30 września 2010 roku. Stronę z ankietą zabezpieczono w taki sposób, by jedna osoba (jeden adres IP) mogła wypełnić ją tylko raz – pozwoliło to na uzyskanie obiektywnych, wolnych od błędów, rzetelnych wyników. Oprogramowanie ankiety wymagało wypełnienia wszystkich pól przez osobę odpowiadającą przed jej ostatecznym wysłaniem i stanowiło podstawę do przeprowadzenia badania na większą skalę. W badaniu „Dentofobia – strach przed dentystą” wzięło udział 3687 osób. Ankieta osiągnęła dużą popularność dzięki wsparciu portalu dentystycznego dentysta.eu oraz kilku innych stron tematycznych. Badani, którzy reprezentowali kilka przedziałów wiekowych (tab. I), pochodzą z różnych regionów Polski (tab. II).
TABELA I. Wiek badanych
| Wiek w latach | % |
| 7-13 14-18 19-25 26-40 41-60 ponad 60 |
2% 30% 37% 20% 11% 1% |
TABELA II. Podział badanych ze względu na miejsce zamieszkania
| Województwo | % |
| śląskie małopolskie wielkopolskie mazowieckie podkarpackie dolnośląskie łódzkie pomorskie kujawsko-pomorskie lubelskie zachodniopomorskie opolskie warmińsko-mazurskie podlaskie lubuskie świętokrzyskie inny kraj niż Polska |
15,43% 11,28% 9,90% 8,90% 7,84% 6,62% 5,99% 5,42% 5,29% 4,67% 4,04% 3,09% 2,93% 2,71% 2,63% 2,09% 1,17% |
Ankieta składała się z 30 pytań jednokrotnego lub wielokrotnego wyboru oraz 6 pytań otwartych. Odpowiadając na nie, osoba badana mogła szczegółowo opisać dany problem. Wyniki ankiety zostały zebrane i zanalizowane w wielowymiarowych tabelach, a następnie przedstawione za pomocą wykresów.
Dentofobia
Wyniki i omówienie badania
• Co tak naprawdę jest przyczyną strachu?
Aby skutecznie walczyć z chorobami, do których niewątpliwie zalicza się dentofobia w jej zaawansowanej postaci, należy przede wszystkim poznać przyczynę strachu, którego podłoże znajduje się w przeszłości (ryc. 1).
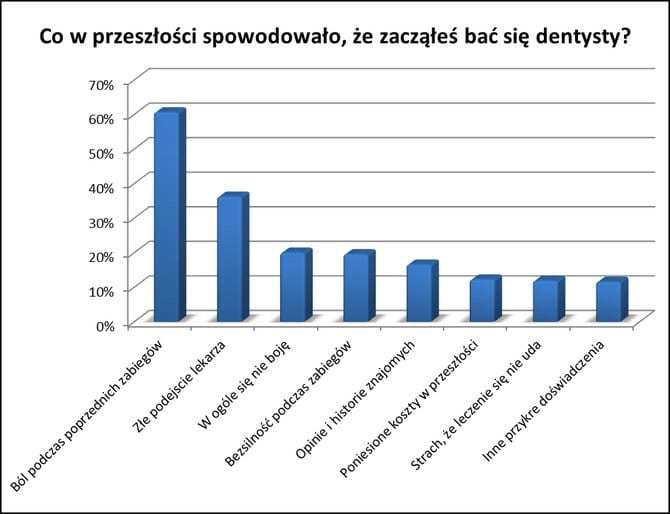
Ryc. 1. Przyczyny strachu przed dentystą.
Około 60% pacjentów podaje – jak można się było spodziewać – ból i przykre doświadczenia w przeszłości jako przyczynę strachu przed dentystą (3). Kolejne 36% to pacjenci, którzy skarżą się na złe podejście lekarza – niespełniającego ich oczekiwań lub traktującego przedmiotowo pracę zawodową. Co piąty pacjent nie wytrzymuje swojej bezsilności podczas zabiegów. Każe to się zastanowić nad stworzeniem w gabinecie atmosfery, w której leczony ma wrażenie panowania nad sytuacją i jej kontrolowania. Chodzi tu szczególnie o cierpliwe podejście dentysty do pacjenta i zaprzestanie działań po wykonaniu przez niego umówionego znaku, np. uniesienia ręki przy nadmiernej bolesności zabiegu. Nie bez znaczenia są także opinie i historie znajomych oraz ceny zabiegów (4).
Dokładne odwzorowanie warunków panujących w jamie ustnej pacjenta pozwala technikom dentystycznym na właściwe opracowanie uzupełnień protetycznych, co zapewnia ich wysoką jakość i komfort użytkowania oraz istotnie przyczynia się do podniesienia jakości życia pacjentów. Jakość wycisku jest w dużej mierze zależna od lekarza stomatologa, ponieważ to on decyduje o wyborze mas wyciskowych, doborze łyżki, metodzie retrakcji dziąseł i pobierania wycisku, sile z jaką łyżka z materiałem jest dociskana do tkanek oraz o czasie w jakim procedura jest przeprowadzana. Po pobraniu wycisku lekarz powinien dokonać jego ewaluacji, a w razie potrzeby wykonać go powtórnie.
Retrakcja dziąseł
Jakość wycisku można ocenić bezpośrednio, za pomocą oka nieuzbrojonego oraz wykorzystując urządzenia powiększające, takie jak lupy, czy mikroskopy. Ocena pośrednia wycisku polega na ocenie odlewu wykonanego na jego podstawie. W niektórych badaniach użyto porównania wycisków wykonanych metodami tradycyjnymi z wyciskami cyfrowymi wykonanymi metodą CAD (Computer Aided Design), co pozwoliło na bardzo dokładną ocenę wymiarów i powierzchni. W warunkach ambulatoryjnych zwykle wycisk oceniany jest wizualnie bez użycia urządzeń powiększających. Według przeprowadzonych badań 89,1% wszystkich wycisków przesyłanych do laboratoriów protetycznych posiada jeden lub więcej defektów widocznych bez użycia powiększenia.
Kryteria oceny wycisku
• brak obecności pustych obszarów i rozdarcia materiału w obrębie linii brzeżnej wycisku – płynne przejście odbicia brzegów stopni w odbicie części naddziąsłowej
• brak pęcherzyków powietrza w pobranym wycisku
• brak ekspozycji masy o większej gęstości przez masę o małej gęstości (w technice dwuczasowej)
• brak nici retrakcyjnej w wykonanym wycisku
• brak wystąpienia nadmiernego ucisku łyżki na tkanki miękkie
• odpowiedni dobór mas wyciskowych w technikach dwuwarstwowych
• prawidłowe zapłynięcie materiałów wyciskowych wokół zębów i tkanek miękkich
• możliwie dokładnie odwzorowane powierzchnie zębów i przyzębia
• ocena ciągłości linii poziomych wycisku (zwykle przy użyciu 10-krotnego powiększenia)
• całkowita polimeryzacja mas wyciskowych w jamie ustnej pacjenta
Przy wykonywaniu wycisku istotna jest precyzja, z jaką łyżka wyciskowa z materiałem zostanie założona na przygotowane uprzednio łuki zębowe, co zapobiega zamykaniu pęcherzyków powietrza wewnątrz wycisku i powstawaniu blaz. Badania dowodzą, że dopasowanie metody retrakcyjnej do wybranego materiału wyciskowego nie jest bez znaczenia.
Retrakcja metodą chemiczno-mechaniczą
Metoda chemiczno-mechaniczna z użyciem nici retrakcyjnych nasączonych chlorkiem glinu, siarczanem żelaza lub roztworem Monsella jest niewskazana do stosowania przy wyciskach wykonywanych siloksanem poliwinylu. Obecność wyżej wymienionych substancji nie wpływa wprawdzie istotnie na wielkość skurczu polimerycznego, jednak jakość odwzorowania szczegółów powierzchni zębów i tkanek miękkich wzrasta, badacze uważają, że kontakt siloksanu winylu z siarką zawartą w siarczanie żelaza oraz roztworze Monsella może hamować lub opóźniać proces jego polimeryzacji. Niepełny proces polimeryzacji bądź opóźniona polimeryzacja wyjaśnia powstawanie niedokładnych odwzorowań na powierzchniach wycisku pomimo wyjęcia wycisku w czasie przewidzianym przez producenta. Użycie nici impregnowanych epinefryną nie obniża jakości wycisku, powoduje dobre odsłonięcie rowka dziąsłowego, a tym samym lepszą penetrację mas wyciskowych do jego wnętrza i dokładność odwzorowania linii brzegowych.
Inną metodą retrakcji jest stosowanie różnego rodzaju past np. Expasyl na bazie tlenku glinu, wprowadzanych na 1-2 minuty do kieszonki dziąsłowej.
Zęby wraz z wiekiem i czynnikami środowiskowymi zmieniają swoją barwę. Wybielanie zębów ma na celu usunięcie przebarwień i poprawienie efektu estetycznego. Przebarwienia koron zębów powstają na skutek działania czynników wewnętrznych (endogennych) oraz zewnętrznych (egzogennych), zmiany barwy zębów można także podzielić na miejscowe i ogólne.
Wybielanie zębów
Do przyczyn przebarwień miejscowych o pochodzeniu wewnętrznym zalicza się urazy (intensywna pourazowa mineralizacja ścian komory), leczenie kanałowe (krwotoki miazgi, pozostawienie martwej miazgi w komorze zęba, stosowane preparaty), uszkodzenia zawiązków zębów stałych, próchnica, atrycja zębów. Przebarwienia zewnątrzpochodne powstają w wyniku diety i korzystania z używek (kawa, herbata, czerwone wino, palenie papierosów), nadmierne użycie płukanek zawierających chlorheksydynę, nadmanganian potasu oraz garbniki. Do grupy czynników ogólnoustrojowych wewnątrzpochodnych zalicza się leczenie tetracyklinami, nadmierną podaż fluoru, choroby systemowe, takie jak mukowiscydoza, choroba hemolityczna i żółtaczka noworodków, nadczynność przedniego płata przysadki, niedoczynność nadnerczy, nadczynność i niedoczynność tarczycy, porfirie, niedorozwój szkliwa i zębiny, osteodystrofia Albrighta. Skuteczne wybielanie zębów wymaga ustalenia przyczyn powstania przebarwień, ponieważ pozwala to dopasować odpowiednią metodę terapii oraz ustalić efekty i okreslić ramy czasowe zabiegu. Przy wykonywaniu zabiegów wybielania zębów zalecana jest kontrola radiologiczna w ciągu 7 kolejnych lat od procedury. Efekt wybielania utrzymuje się od 1-12 miesięcy, trwałość odcienia jets w dużej mierze zależna od diety pacjenta, jego nałogów, przestrzegania zaleceń w trakcie zabiegów. Korzystne jest unikanie pożywienia zawierającego barwniki, a także używanie past wybielających i utrzymywanie higieny jamy ustnej na wysokim poziomie.
Mechanizm działania środków wybielających
Wybielanie zębów jest możliwe dzięki znacznej przepuszczalności szkliwa i zębiny, co umożliwia wnikanie do nich środków wybielających. Do wybielania zębów stosowana są nadtlenki wodoru, mocznika oraz nadboran sodu, związki te rozszczepiają się w środowisku tkanek zęba tworząc rodniki tlenowe, które dzięki dużej reaktywności rozszczepiają duże cząsteczki barwników na cząsteczki mniejsze, które są później usuwane poprzez dyfuzję na zewnątrz zęba.
Wybielanie zębów metodą domową
Metoda ta polega na wykonaniu indywidualnej szyny z przezroczystego elastycznego materiału dla pacjenta do której nakładany jest preparat wybielający, pacjent sam umieszcza nakładkę z preparatem na zębach. Jest to wybielanie zewnętrzne, skuteczne jedynie w przypadku zębów żywych. Pierwszy etap wybielania domowego rozpoczyna się w gabinecie stomatologicznym,pacjent jest informowany o planie zabiegu, jego przebiegu, możliwych działaniach niepożądanych, szansie na powodzenie oraz kosztach. Lekarz ocenia stan uzębienia pacjenta, szczelność wypełnień, stan przyzębia oraz w razie potrzeby wykonuje zdjęcie rentgenowskie w celu wykluczenia procesów zapalnych i innych zmian w strukturach zęba. Lekarz przeprowadza profesjonalne oczyszczenie zębów pacjenta. Ustalany jest kolor wyjściowy zębów pacjenta oraz kolor pożądany. Od pacjenta pobiera się wycisk, który jest następnie odsyłany do laboratorium, gdzie technicy wykonują model gipsowy i dopasowaną do modelu nakładkę, która dokładnie odwzorowuje łuk zębowy pacjenta. Dokładnie wykonana nakładka minimalizuje ryzyko przecieku preparatu i podrażnienia dziąseł. Pacjent otrzymuje od lekarza nakładkę wraz z preparatem wybielającym – najczęściej są to substancje w formie żelu, umieszczone w tubostrzykawkach, co ułatwia ich użycie. Pacjent po oczyszczeniu zębów umieszcza w nakładce małe ilości żelu i zakłada ją na łuk zębowy, można także posmarować dziąsła wazeliną w celu zapobieżenia ewentualnym ich podrażnieniom przez preparat wybielający. Nadmiar żelu, który po dociśnięciu nakładki wypłynął należy usunąć palcem lub za pomocą gazy. Usta należy przepłukać dwukrotnie nie połykając wody. Pacjent może nosić nakładkę w czasie dnia lub na noc, całkowity czas noszenia nakładki w ciągu jednego dnia nie powinien przekraczać 5 godzin. Niektórzy badacze nie zalecają noszenia nakładki w trakcie snu ze względu na ryzyko zaburzeń czynności stawów skroniowo-żuchwowych. W czasie noszenia nakładki nie powinno się jeść ani pić. Po zdjęciu szyny należy usunąć preparat z jamy ustnej i przepłukać ją wodą. Nakładkę należy umyć ciepła, ale nie gorącą wodą, a następnie osuszyć. Osoby palące powinny się w trakcie wybielania powstrzymać od palenia papierosów, ponieważ uwalniające się w trakcie wybielania wolne rodniki tlenowe mogą się przyczyniać do wzmożenia działania rakotwórczego substancji smolistych zawartych w dymie papierosowym. Podczas całego czasu wybielania nie powinno się spożywać owoców cytrusowych, jabłek, soków, czerwonego wina, kawy, herbaty i innych pokarmów, które zawierają barwniki, ponieważ może to prowadzić do powstawania przebarwień w szkliwie. Kwaśne pokarmy przyczyniają się ponadto do uszkadzania szkliwa, poprzez jego rozpuszczanie.
Metoda domowa polecana jest do usuwania żółtawo-brązowawych przebarwień powstałych w wyniku starzenia się zębów, łagodnej fluorozy lub nieznacznego użycia tetracyklin. W metodzie tej zalecane jest użycie preparatów z zawartością 10-15% nadtlenku karbamidu. Wybielanie domowe trwa zwykle od 7 do 21 dni, możliwe jest rozjaśnienie zębów o około 2 tony. Pierwsze efekty metody domowej widoczne są po kilku dniach.
Zalety metody domowej:
• Pacjent przeprowadza wybielanie w dowolnie wybranym przez siebie czasie, nie ma potrzeby zgłaszania się każdorazowo do gabinetu
• Nie ma potrzeby użycia koferdamu, co jest korzystne dla osób z alergia na lateks
• Proces wybielania zębów bezpieczniejszy dla zębów, ze względu na rozłożenie w czasie
• Niższe koszty w porównaniu do metod gabinetowych
• Wykonane nakładki są wielorazowe i służą przez dłuższy czas
• Nakładka jest mało widoczna, można ją stosować w ciągu dnia, także w trakcie pracy
Wady metody domowej:
• Pacjent musi pamiętać o regularnym noszeniu nakładek, w przeciwnym razie pożądany efekt nie zostanie osiągnięty
• Zbyt długi czas noszenia nakładki może spowodować przejściową nadwrażliwość szyjek zębów
• Noszenie nakładek zwłaszcza nocą może wywołać zaburzenia w stawach skroniowo-żuchwowych
• Czas wybielania jest dłuższy niż w przypadku wybielania gabinetowego
• Metodą domową nie można usunąć wszystkich rodzajów przebarwień
• Możliwe podrażnienie układu pokarmowego w przypadku połknięcia preparatu – objawia się uczuciem ciśnienia w żołądku i/lub krótkotrwałymi nudnościami
• Wymowa podczas noszenia nakładki jest mniej wyraźna
Koszt wykonania nakładki wynosi średnio 100-200 złotych za łuk, natomiast żele wybielające do nakładek to koszt 30-50zł. Metoda domowa jest tańsza w porównaniu do gabinetowej, koszt ponownego wybielania jest ograniczony do kosztów środka wybielającego – przy założeniu, że u pacjenta nie zmieniło się położenie zębów w łuku, np. w wyniku leczenia ortodontycznego lub urazu oraz że nakładki są przechowywane w należyty sposób.
Zespół Treachera-Collinsa (TCS) – dyzostoza żuchwowo-twarzowa, nazywany także zespołem Franceschettiego, Zwahlena i Kleina lub TCOF1, jest rzadkim schorzeniem o podłożu genetycznym występującym statystycznie raz na 10000 urodzeń. Spowodowany jest on mutacją genu na ramieniu długim chromosomu 5 (locus 5q32-33,1, określanym także jako locus TCOF1). Gen ten odpowiedzialny jest za produkcję białka, które zostało nazwane „melasowym” (z ang. treackle). Uważa się, że białko to pełni funkcję pomocniczą w rybosomalnej transkrypcji DNA podczas wielu istotnych etapów rozwoju embrionalnego struktur w obrębie twarzoczaszki, wytwarzanie przez organizm białka o nieprawidłowej strukturze znacznie upośledza procesy rozwojowe lub zupełnie je hamuje.
Dyzostoza żuchwowo-twarzowa dziedziczona jest według wzoru autosomalnego dominującego. Zespół ten może objawiać się z różną intensywnością, w bardzo ciężkich wypadkach odnotowano niedorozwój 30-40% kości czaszki. W 60% przypadków mutacje prowadzące do wystąpienia zespołu Treachera-Collinsa nie występowały wcześniej w rodzinie chorego, są więc zdarzeniami nowymi. Szacuje się, że u osób u których wystąpił zespół Treachera-Collinsa występuje 50% prawdopodobieństwo urodzenia dziecka z tym schorzeniem.
Etiologia
W zespole Treachera-Collinsa występuje niewłaściwe kształtowanie się pierwszego i drugiego łuku skrzelowego, istnieją hipotezy, że spowodowane jest to wadliwą budową białka transportu jądrowego koniecznego do prawidłowego rozwoju twarzoczaszki. Zaobserwowano także, że objawy zespołu Treachera-Collinsa są bardzo podobne do objawów przedawkowania witaminy A zarówno u dzieci urodzonych przez matki stosujące codzienną suplementację witaminą A w czasie ciąży w dawce 2000IU. W dyzostozie żuchwowo-twarzowej obserwuje się zniekształcenia twarzoczaszki – są one wynikiem nieprawidłowego rozwoju łuków skrzelowych. Z pierwszego łuku skrzelowego, zwanego inaczej łukiem żuchwowym, rozwijają się mięśnie żucia – brzusiec przedni mięśnia dwubrzuścowego, mięsień bródkowo-gnykowy, mięsień napinacz bębenka i mięsień napinacz podniebienia miękkiego, kości żuchwy i szczęki, kosteczki słuchowe – młoteczek i kowadełko, nerw trójdzielny oraz tętnica szczękowa. Z drugiego łuku skrzelowego, zwanego inaczej łukiem gnykowym powstają mięśnie odpowiedzialne za mimikę, jak mięśnie jarzmowe mniejszy i większy, mięsień okrężny ust i okrężny oka, mięsień policzkowy i mięsień szeroki szyi, a także strzemiączko, mięsień strzemiączkowy, mięsień rylcowo-gnykowy, brzusiec tylny mięśnia dwubrzuścowego, wyrostek rylcowaty, rogi mniejsze kości gnykowej oraz nerw twarzowy. W zespole Treachera-Collinsa procesy te zostają w większym lub mniejszym stopniu zaburzone, co prowadzi do niedorozwoju powyższych struktur anatomicznych, co upośledza ich funkcje fizjologiczne.
Diagnoza
Rozpoznanie oparte jest na ocenie cech klinicznych tego zespołu. Na zdjęciach rentgenowskich widoczne są niedorozwinięte struktury kostne w obrębie twarzoczaszki. Występuje niedorozwój łuków brwiowych, hipoplazja łuków jarzmowych, hipoplazja żuchwy, spłaszczenie lub brak plastyczności wyrostka dziobiastego i kłykciowego żuchwy oraz zmiany w ukształtowaniu podstawy czaszki.
Osoby z zespołem Treachera-Collinsa wykazują także odmienne ukształtowanie oczu, częsta jest mikroftalmia (małoocze), szczelina oczna jest skośna antymongolska – odwrotnie jak w zespole Downa, występuje także fałd antymongolski, brak jest dolnych punktów łzowych, występuje niewiele rzęs, często obserwuje się ich całkowity brak, zwłaszcza w obrębie dolnej powieki. Ponadto obserwuje się spłaszczenie policzków, szczelinę w dolnej powiece, utratę wzroku, zeza, gwałtowne mimowolne drganie gałek ocznych (nystagmus), zarośnięcie przewodu słuchowego zewnętrznego (atrezja), niewykształcenie lub deformację małżowin usznych, mikrocję (niewykształcenie lub brak odpowiednich struktur w obrębie ucha) oraz głuchotę. U wielu pacjentów występuje rozszczep podniebienia i podniebienie gotyckie lub oba jednocześnie, ponadto pacjenci prezentują przerost ust (makrostomia) oraz niewykształcenie ślinianek przyuszniczych. W zespole Treachera-Collinsa występują także zmiany w obszarze innym niż twarzoczaszka, obecne są wady układu sercowo-naczyniowego, deformacja kręgów szyjnych, wady nerek, atrezja (zarośnięcie) nozdrzy, zniekształcenie kończyn. Wielu pacjentów cierpi także na zespół bezdechu śródsennego (SAS – sleep apnea syndrome) często prowadzący do nagłej śmierci. Oprócz wad cielesnych występuje także niedorozwój umysłowy, trudności z uczeniem się oraz w wielu przypadkach odrzucenie przez społeczeństwo będące wynikiem braku akceptacji. Możliwa jest diagnoza w okresie prenatalnym za pomocą badania ultrasonograficznego od 20. tygodnia ciąży, a także badania molekularne poprzez pobranie płynu owodniowego na zasadzie biopsji. W badaniu ultrasonograficznym można zaobserwować takie wady rozwojowe jak mikrognację (niedorozwój żuchwy), wady oczodołów, w tym skośne ułożenie szczeliny oczodołowej, niedorozwój kości jarzmowych i łuków jarzmowych, brak, zniekształcenie lub występowanie wiotkich małżowin usznych, można także zaobserwować niskie osadzenie małżowin usznych oraz ich zlanie się z naroślami skórnymi, widoczne są także rozszczepy podniebienia oraz zarośnięcie nozdrzy. W celu postawienia diagnozy po urodzeniu dziecka można stosować także tomografie komputerową, która zapewnia bardzo dobre obrazowanie struktur anatomicznych.
Więcej
Wszczepianie zawiązków zębów?!
Implanty zyskują sobie coraz większe grono zwolenników zarówno wśród lekarzy, jak i pacjentów. Nowoczesne technologie zapewniają coraz lepsze dopasowanie wszczepów do ludzkiego organizmu w zakresie biozgodności i funkcjonalności – dzięki temu przypadki odrzucania implantów są coraz rzadsze, a pacjent nie odczuwa różnicy pomiędzy zębami naturalnymi a wszczepem, czego nie da się osiągnąć stosując protezy. Ponadto na implantach można opierać konstrukcje protetyczne, takie jak korony, mosty czy protezy wyjmowane. Zastosowanie wszczepów znacznie poprawia funkcje żucia, wygląd, samopoczucie, wymowę co prowadzi do podniesienia jakości życia pacjentów.
Czego pacjent może oczekiwać od stomatologa
Osoby, którym wszczepiono implanty zyskują trwały efekt kosmetyczny i funkcjonalny – dobrze wykonany wszczep wraz z odbudową jest bardzo trudny do odróżnienia od zębów naturalnych, ponadto nie wypada – zapewnia poczucie komfortu w trakcie jedzenia, nie zmienia smaku potraw. Pacjent udający się na konsultację ma prawo oczekiwać wyczerpujących informacji co do szacunkowych kosztów wszczepienia implantu, rokowania, przeciwwskazań, przebiegu zabiegu oraz możliwych zagrożeń w trakcie i po procedurze. Kosztów leczenia nie da się niestety określić co do złotówki – koszt końcowy zwykle różni się od szacowanego w granicach 5-10% na korzyść lub niekorzyść pacjenta. Niestety nie u każdej osoby można stosować wszczepy; przed przystąpieniem do końcowej oceny konieczne jest przeprowadzenie dokładnego wywiadu lekarskiego oraz wykonanie badań radiologicznych na podstawie których można określić gęstość kości oraz rozmieszczenie poszczególnych struktur. Wykonanie badań oraz przestudiowanie historii chorób daje realne możliwości określenia szans na powodzenie zabiegu – niestety nigdy nie am stuprocentowej gwarancji, ponieważ każdy organizm jest inny i jego reakcja na implant może odbiegać od reakcji zaobserwowanych u większości pacjentów. Pomimo to u ponad 92% leczonych osób implanty przyjmują się bez większych problemów. Zabiegi implantologiczne przeprowadzane są przez wykwalifikowanych specjalistów w atestowanych gabinetach / klinikach stomatologicznych. Przeważająca większość tych instytucji daje gwarancję skuteczności leczenia. Dobrze wykonane implanty zapewniają komfortowe samopoczucie i charakteryzują się wysoką trwałością – około 80% z założonych wszczepów utrzymuje zespolenie z kością ponad 10-15 lat i dłużej.
Wskazania i przeciwwskazania do stosowania implantów
Wskazania:
• bezzębie – całkowity brak uzębienia, zarówno w przypadku utraty zębów stałych, jak i brak zębów stałych na podłożu genetycznym (nieobecność zawiązków zębów stałych)– na implantach można osadzać różne konstrukcje protetyczne, takie jak korony, mosty czy protezy
• występowanie przerw pomiędzy zębami spowodowanych utratą zębów stałych (poprawa funkcjonowania i estetyki aparatu żucia)
• nietolerancja typowych protez
Przeciwwskazania miejscowe:
• niewystarczające wymiary i stan wyrostka kostnego – np. kość nie jest wystarczająco gruba i gęsta – obecnie można korygować niektóre z takich przypadków poprzez zabiegi regeneracji kości
• brak miejsca pomiędzy zębami górnymi i dolnymi lub między zębami sąsiednimi
• nieprawidłowa błona śluzowa w planowanym miejscu umieszczenia wszczepu, np. zbyt cienka lub niewystarczająco ukrwiona błona śluzowa (często występująca u palaczy)
Przeciwwskazania ogólne bezwzględne:
• obecność chorób wyniszczających organizm, takich jak nowotwory, AIDS, sepsa, alkoholizm, narkomania
• zły stan higieny jamy ustnej – obecność ubytków próchnicowych, kamienia nazębnego, zły stan dziąseł itp.
• cukrzyca
• choroby psychiczne
• ciąża
• wiek: mniej niż 16 a więcej niż 65 lat – u osób przed 16. rokiem życia nie zakończył się proces wzrostu kości, u osób po 65. roku życia zdolność do regeneracji kości jest mniejsza, także ich wytrzymałość maleje
Przeciwwskazania ogólne względne:
• zaawansowane parodontopatie
• zapalenia przyzębia lub błony śluzowej
• bruksizm – nawykowe zgrzytanie zębami
• zapalenia kości
• osteoporoza
• choroby reumatyczne
• nadciśnienie tętnicze, niewydolność serca, wrodzone wady serca, oraz schorzenia choroby układu krążenia obecność protez zastawek sercowych
• choroba Parkinsona
• choroby szpiku kostnego
• astma, przewlekłe zapalenie oskrzeli, przebyta gruźlica oraz inne schorzenia układu oddechowego
• choroby psychiczne
• choroby nerek
• schorzenia wątroby
• alergie
• terapia niektórymi lekami
Ile trwa wszczepienie implantu?
Czas leczenia zależny jest od wybranej techniki – wszczepienie implantu oraz osadzenie na nim odbudowy – korony lub mostu – może trwać łącznie od kilku godzin do kilku miesięcy, ponieważ w jednych systemach procedura odbywa się w ciągu jednej wizyty, natomiast w innych kilka wizyt rozłożonych jest w czasie. Czas potrzebny do całkowitego zagojenia się rany oraz zrośnięcia się zewnętrznych powierzchni implantu z kością (osteointegracji) jest różny dla szczęki (5-6 miesięcy) i żuchwy (2-3 miesiące). Osteointegracja możliwa jest dzięki pokryciu powierzchni wszczepu plazmą tytanową lub hydroksyapatytem. Obydwie substancje są porowate, co umożliwia wrastanie w nie komórek kostnych. Dzięki osteointegracji implanty są stabilne, tzn. nie chwieją się i nie wypadają, a ich usunięcie wymaga usunięcie fragmentu kości, w którym są zakotwiczone.
Implanty można podzielić ze względu na sposób ich osadzania w kości na:
Za zakażenia zębopochodne uważa się wszelkie infekcje, które biorą swój początek w miazdze zęba, przyzębiu, wyrostkach zębodołowych szczęki i żuchwy, jak również w tkankach bezpośrednio do nich przylegających. Przeważająca większość zakażeń zębopochodnych ma charakter bakteryjny. Podatność na zakażenie oraz wielkość jego ekspansji zależy od ogólnej odporności organizmu. Według badań naukowych do 90% wszystkich zapaleń w obrębie twarzy i jamy ustnej ma podłoże zębopochodne. Uważa się, że ponad 2/3 z nich to zapalenia okołowierzchołkowe. Ostre zapalenia okołowierzchołkowe często manifestują się w postaci ropni w obrębie wyrostków zębodołowych, które następnie przekształcają się w ropnie okołowierzchołkowe.
Zapalenia zębopochodne powodowane są najczęściej przez obecność martwych zębów, zapalenia okołokoronowego (pericoronitis) – pojawiają się one zwykle w przypadku zębów częściowo zatrzymanych, zwłaszcza zębów trzonowych trzecich. Mogą się one pojawiać także po osunięciu zębów, w przypadku występowania nieleczonych nowotworów, takich jak np. ziarniniaki w okolicy okołokorzeniowej czy też przy współistnieniu zainfekowanych torbieli. W rzadkich przypadkach zapalenia zębopochodne notowane są po zabiegach chirurgicznych, urazach, takich jak złamania, oraz przy występowaniu zmian patologicznych węzłów chłonnych i gruczołów ślinowych.
Zapalenie zatoki szczękowej (sinusitis maxillaris)
Według przeprowadzonych badań około 10-12% wszystkich zapaleń zatoki szczękowej ma podłoże zębopochodne. Zapalenie zatok szczękowych można podzielić na ostre (sinusitis maxillaris acuta) – trwa ono poniżej trzech tygodni, zapalenie podostre – czas trwania zawiera się w przedziale od trzech tygodni do trzech miesięcy (sinusitis maxillaris subacuta) oraz zapalenie przewlekłe – czas trwania przekracza trzy miesiące (sinusitis maxillaris chronica).
Przyczyny
Najbardziej powszechnymi przyczynami takiego zapalenia zębopochodnego są ropnie znajdujące się w wyrostach zębodołowych szczęki oraz choroby przyzębia w jej obrębie. Patologiczne zmiany wywołane tymi schorzeniami perforują do jamy zatoki szczękowej i powodują przenoszenie się zakażenia na śluzówkę wyścielającą te zatoki i wywołuje odpowiedź immunologiczną. Innymi przyczynami zębopochodnymi zapaleń zatoki szczękowej może być obecność ciał obcych, które dostały się do ich wnętrza w czasie zabiegów stomatologicznych, jak również wywołane ekstrakcją zębów szczęki, zwłaszcza trzonowych trzecich, otwarcie zatoki szczękowej do jamy ustnej – występuje ono wówczas, gdy korzenie zębów trzonowych sięgają aż do wnętrza zatoki. U osób, które miały wykonywane zabiegi chirurgiczne w obrębie wyrostka zębodołowego szczęki należy także podejrzewać zębopochodną przyczynę zapalenia zatok szczękowych.
Objawy
Głównymi objawami zębopochodnego zapalenia zatoki szczękowej są bóle w okolicy zębów górnych, zwłaszcza trzonowców, bóle głowy, nadwrażliwość w obrębie przedniej części zatoki szczękowej.
Diagnostyka
Zębopochodne zapalenie zatok szczękowych manifestuje się obecnością wielu rożnych mikroorganizmów zarówno tlenowych jak i beztlenowych, z czego przeważają drobnoustroje beztlenowe. Największymi grupami bakterii spotykanych w wyżej omawianym zakażeniu są streptokoki, pałeczki Gram-ujemne oraz enterobakterie. Leczenie tego rodzaju zapalenia wymaga rozpoznania jego przyczyny i jej usunięcia, poleca się wykonać zdjęcia rentgenowskie, w celu określenia zasięgu zapalenia w obrębie zatok. Dzięki rentgenodiagnostyce można zauważyć obecne w zatoce ciała obce, które mogły wywołać schorzenie. Należy także wykonać badanie tkanek przyzębia, aby określić ich udział w zapaleniu. U pacjentów, u których było przeprowadzone leczenie zapalenia zatok bez podejrzenia przyczyn zębopochodnych, ale które nie przyniosło miarodajnych wyników należy także podejrzewać, że zapalenie ma swoje źródło w tkankach przyzębia. W badaniach mikroskopowych obserwuje się zwiększoną ilość leukocytów w polu widzenia.
Powikłania
Nieopanowanie zapalenia zatoki szczękowej lun brak podjęcia leczenia może doprowadzić do poważnych komplikacji wewnątrzczaszkowych, takich jak zapalenie opon mózgowych (meningitis), ropień mózgu (abscessus cerebri), ropień nadtwardówkowy (abscessus epidurale), ropniak podtwardówkowy (empyema subdurale), przetoka ustno-zatokowa (fistula oroantralis), zakrzepowe zapalenie zatoki jamistej (thrombosinusitis cavernosa), zapalenie szpiku (osteomyelitis), zapalenie tkanki łącznej (cellulitis). Zmiany te są niebezpieczne dla zdrowia i życia pacjenta, szacuje się, że śmiertelność przy tych powikłaniach waha się od 5 do 20% przypadków.
Leczenie
W zapaleniach zatoki szczękowej pochodzenia bakteryjnego wdraża się terapię mającą na celu opanowanie infekcji, zmniejszenie obrzęku dotkniętych tkanek oraz udrożnienie ujść, tak, aby wydzielina ropno-śluzowa mogła wypłynąć z zatoki. Leczenie farmakologiczne wymaga zastosowania antybiotyków, kropli do nosa oraz niekiedy inhalatorów, Konieczne jest ustalenie i usunięcie przyczyny zapalenia, jeżeli wykonana została ekstrakcja zęba możliwe jest umieszczenie kateteru w zębodole i wypłukiwanie ropnej wydzieliny z zatok roztworem soli fizjologicznej. W niektórych przypadkach stosuje się zabieg chirurgiczny w postaci antrostomii nosowej, przez co uzyskuje się dostęp do zatok szczękowych objętych zakażeniem i wykonuje się drenaż.
Neuralgia jest definiowana jako ból rozchodzący się w miejscach przebiegu danego nerwu. Uważa się, że jej przyczyną jest zaburzenie prawidłowego funkcjonowania nerwu, czyli zmiany w przewodzeniu bodźców. Do najczęściej spotykanych neuralgii w obrębie twarzy należą:
• neuralgia nerwu trójdzielnego (V nerw czaszkowy)
• neuralgia nerwu językowo-gardłowego (IX nerw czaszkowy)
• neuralgia potyliczna
• neuralgia popółpaścowa.
Neuralgia nerwu trójdzielnego (neuralgia trigeminale)
Głównym objawem tego schorzenia jest czucie powierzchownego, przeszywającego, nagłego i silnego bólu podobnego do kopnięcia przez prąd elektryczny. Ból ten jest zwykle jednostronny – pojawia się i przechodzi raptownie, często powraca. Obszar jaki on obejmuje pokrywa się z sektorami twarzy unerwianymi przez gałązki czuciowe nerwu trójdzielnego. Pomiędzy atakami neuralgii nie notuje się dolegliwości bólowych, czasami występuje zmniejszenie czucia na obszarach unerwianych przez nerw trójdzielny. Ból ten trwa od kilku sekund do dwóch minut. Pojawia się on w czasie codziennych czynności, w trakcie jedzenia, pielęgnacji twarzy, mycia zębów, czy nawet zwykłej rozmowy. Szacuje się, że 4-5 osób poniżej 20 roku życia na 100000 zapada na neuralgię nerwu trójdzielnego, natomiast po 60 roku życia ilość chorych wzrasta do 20 na 100000. Kobiety cierpią na neuralgię częściej niż mężczyźni, stosunek płci żeńskiej do męskiej ma się jak 3:2. Uważa się, ze neuralgia nerwu trójdzielnego wywoływana jest w pierwszej kolejności poprzez mechaniczny ucisk na nerw, w miejscu, gdzie opuszcza on most i kieruje się w przestrzeni podpajęczynówkowej w stronę jamy nerwu trójdzielnego (cavum trigeminale) w pobliżu wierzchołka części skalistej kości skroniowej. W większości przypadków ucisk ten wywiera główne naczynie tętnicze. Innymi potencjalnymi przyczynami neuralgii mogą być demielinizacja włókien nerwowych w przebiegu stwardnienia rozsianego, rozsiane ogniska zapalne w postaci ropni, a także resorpcja kości szczęki lub żuchwy przebiegająca z podrażnieniem nerwu trójdzielnego. Ten typ neuralgii występuje szacunkowo u 1% pacjentów ze stwardnieniem rozsianym, a u 2 do 8% wszystkich osób cierpiących na neuralgię diagnozuje się także stwardnienie rozsiane.
Diagnoza stawiana jest przede wszystkim na podstawie przeprowadzonego wcześniej wywiadu lekarskiego. Głównymi kryteriami są dolegliwości bólowe w postaci pokrywania się ich z obszarami unerwianymi przez nerw trójdzielny, ból musi być jednostronny, powierzchowny i ostry, a w przerwach pomiędzy jego atakami nie powinny występować dolegliwości bólowe. Aby wykluczyć współistnienie innych schorzeń wskazane jest wykonanie badania fizykalnego jamy ustnej wraz z uzębieniem. Zaleca się także przebadanie innych nerwów czaszkowych, w neuralgii zwykle nie pojawiają się zaburzenia motoryczno-sensoryczne (ruchowo-czuciowe), chociaż w dokładniejszym badaniu można wykryć drugorzędowe przyczyny neuralgii wynikające z patologii onerwia.
W terapii farmakologicznej stosuje się, zwłaszcza na początku, leki przeciwpadaczkowe, takie jak np. karmazepina. Oprócz tego wdrażane są leki przeciwbólowe. Ponadto stosuje się dożylne podawanie płynów, u osób, które zagrożone są odwodnieniem, będącym wynikiem niemożności doustnego przyjmowania płynów.
Więcej
wiesz, że...
dentysta.eu
- Ostatni dzwonek, aby tanio wymienić plomby amalgamatowe na lepsze i zdrowsze
- Co pacjenci sądzą o dentystach i jak (nie)wiele na ten temat wiedzą stomatolodzy
- Zapowiedź wyników badania – czego oczekują pacjenci i co dentyści wiedzą o pacjentach
- Pacjenci – widma prześwietleni: wyniki ankiety o umawianiu wizyt
- Wyniki ankiety „Uśmiech a status społeczny”
forum
u nas!
 Wysoka odwiedzalność serwisu sprawia że bez problemu dotrzesz do swoich nowych klientów!
Wysoka odwiedzalność serwisu sprawia że bez problemu dotrzesz do swoich nowych klientów!
 Wystarczy że dodasz swój gabinet w ogłoszeniach portalu - szybko i zupełnie za darmo!
Wystarczy że dodasz swój gabinet w ogłoszeniach portalu - szybko i zupełnie za darmo!
 Dzięki promowaniu zyskają również Twoi klienci którzy łatwo Cię odnajdą!
Dzięki promowaniu zyskają również Twoi klienci którzy łatwo Cię odnajdą!
 Nadal się wahasz? Kliknij:
Dowiedz się więcej
Rozwiń
Nadal się wahasz? Kliknij:
Dowiedz się więcej
Rozwiń